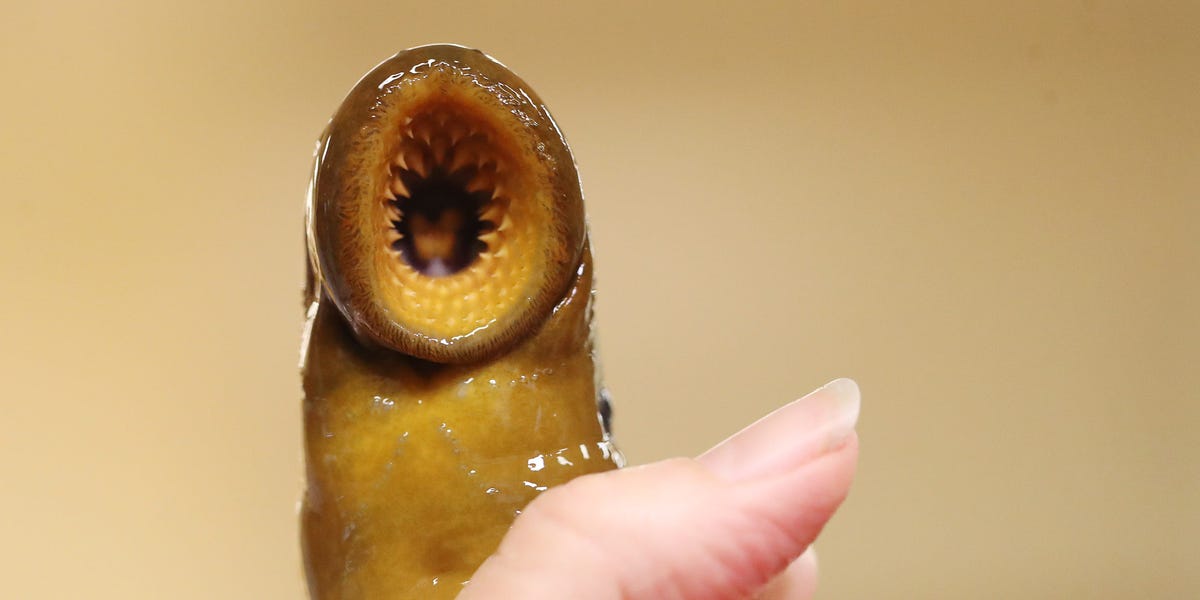
Un pez parásito espeluznante que prospera chupando la sangre de sus anfitriones, ganando el apodo de « pez vampiro », está regresando a los Grandes Lagos después de que la pandemia interrumpió el control de la población de la especie.
El pez, que tiene una fila circular de dientes, una lengua dentada y una forma de anguila, se llama lamprea de mar.
Según la Administración Nacional Oceánica y Atmosférica, las lampreas marinas son nativas del Océano Atlántico norte y oeste, pero invadieron los Grandes Lagos a principios del siglo XIX a través del Canal Welland, que conecta el Lago Ontario y el Lago Erie.
« En una década, obtuvieron acceso a los cinco Grandes Lagos, donde rápidamente se pusieron a trabajar depredando los peces comercialmente importantes de los lagos, como la trucha, el pescado blanco, la perca y el esturión », escribió la NOAA. « En un siglo, la pesca de la trucha colapsó, en gran parte debido a la proliferación desenfrenada de la lamprea ».
En la década de 1960, las lampreas marinas redujeron la captura comercial anual de truchas de lago en la parte superior de los Grandes Lagos de alrededor de 15 millones a medio millón de libras, informó Wired.
La Comisión de Pesca de los Grandes Lagos, junto con el Servicio de Pesca y Vida Silvestre de EE. UU. y Pesca y Océanos de Canadá, ha sido responsable de gestionar la población de esta especie altamente invasiva, y las agencias lo han hecho con un éxito considerable.
La comisión de pesca promociona en su sitio web que las poblaciones de lampreas marinas se han reducido en un 90% « en la mayoría de las áreas de los Grandes Lagos ».
Pero entre 2020 y 2021, la pandemia de COVID-19 y las consiguientes restricciones de viaje interrumpieron la capacidad de las agencias para salir y realizar algunas de las operaciones de gestión de la población. Ahora, los administradores de pesquerías dicen que la población de peces parásitos ha aumentado en los Grandes Lagos, informó The Wall Street Journal.
No está claro cuánto aumentó exactamente la población, pero según un informe de 2022 de Undark Magazine, una publicación científica sin fines de lucro, los equipos responsables del control de la población solo pudieron tratar alrededor del 25 por ciento de los flujos objetivo en 2020. Al año siguiente, los equipos alcanzaron el 75% de sus objetivos, informó la publicación.
El tratamiento puede ser costoso y laborioso, y requiere la aplicación cuidadosamente programada de pesticidas llamados lampricidas para reducir la población.
Se estima que controlar la población de lampreas cuesta entre $ 15 y $ 20 millones al año, según Wired.